Las fuerzas moleculares son las que atraen las moléculas entre sí.
Pinned to
167
0
0
No tags specified
|
|
Created by Juan Pablo Valenzuela
over 7 years ago
|
|
Close
|
|
Created by Juan Pablo Valenzuela
over 7 years ago
|
|

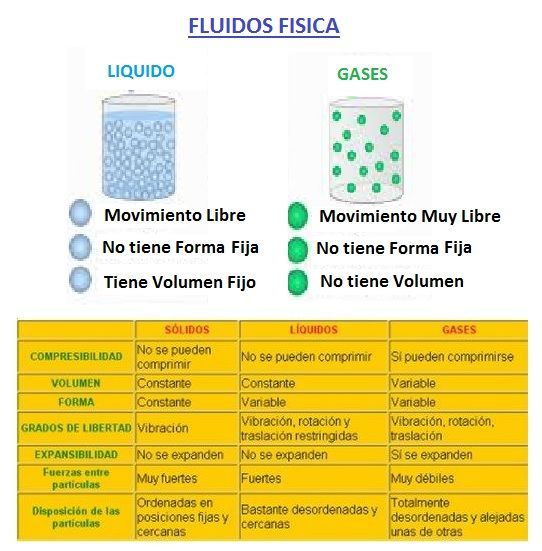
La diferencia entre los estados condensados (líquidos y sólidos) y el estado gaseoso es la distancia entre las moléculas.
Las fases son los distintos estados de una sustancia presentes en un sistema. Una fase es una parte homogénea de un sistema y aunque está en contacto con otras partes del sistema, está separada de esas partes por un límite bien definido.


Fuerzas intramoleculares:
Mantienen juntos a los átmos de una molécula. Estabilizan a las moléculas individuales.
Fuerzas dipolo-dipolo:
Fuerzas de atracción que actúan entre moléculas polares.
Fuerzas ion-dipolo:
Fuerzas de atracción que actúan sobre un ión y una molécula polar. Ej: Hidratación.
Dipolo inducido: la separación de las cargas positiva y negativa del átomo (o molécula no polar) se debe a la proximidad de un ion o una molécula polar.
Polarizabilidad: la facilidad para distorcionar la distribución electrónica del átomo.
Propiedades de los líquidos:
Tensión superficial: es la cantidad de energía necesaria para estirar o aumentar la superficie de un líquido por unidad de área.
Cohesión: la atracción intermolecular entre moléculas semejantes.
Adhesión: la atracción entre moléculas distintas, como las del agua y un tubo de vidrio.
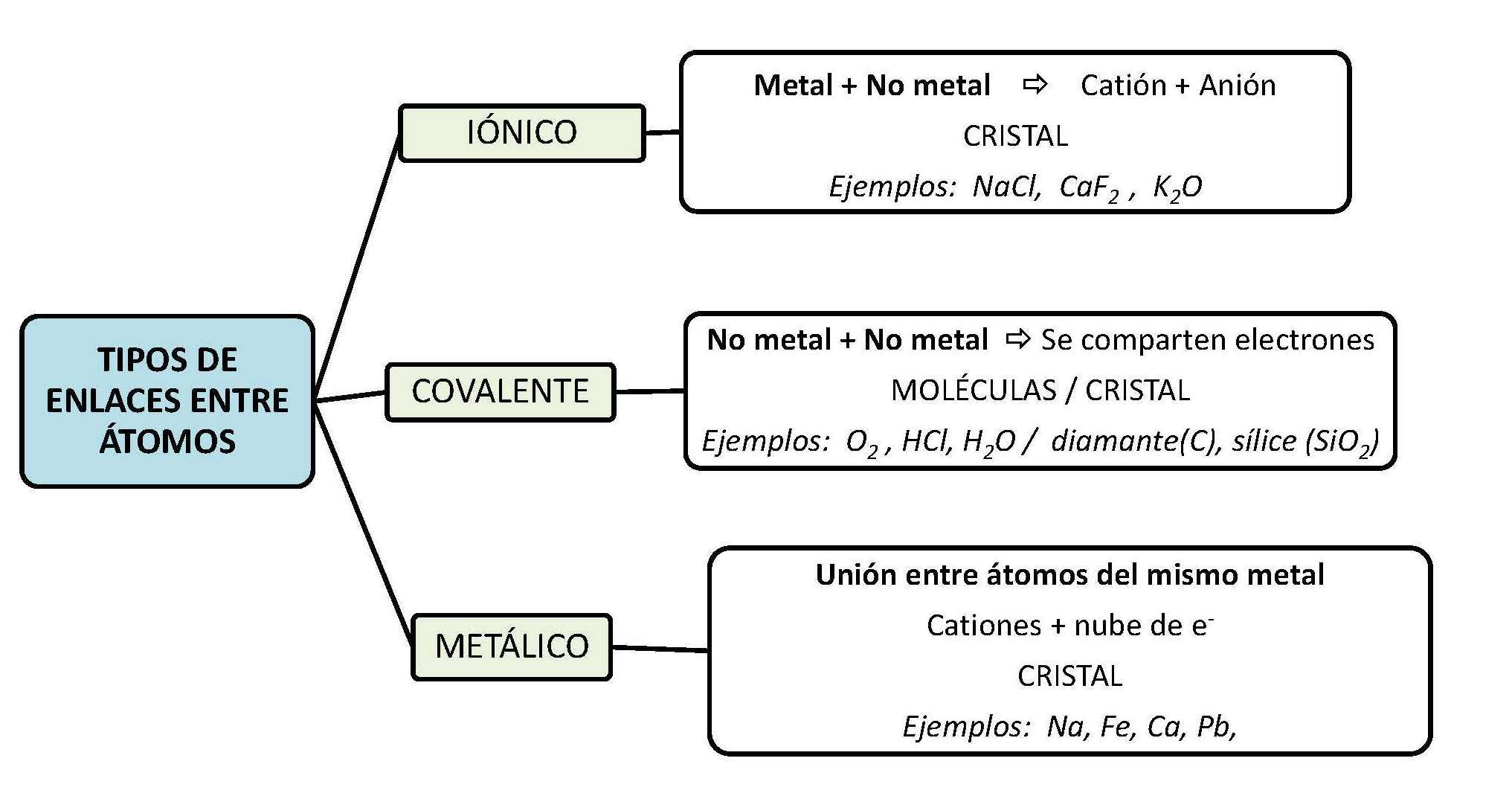
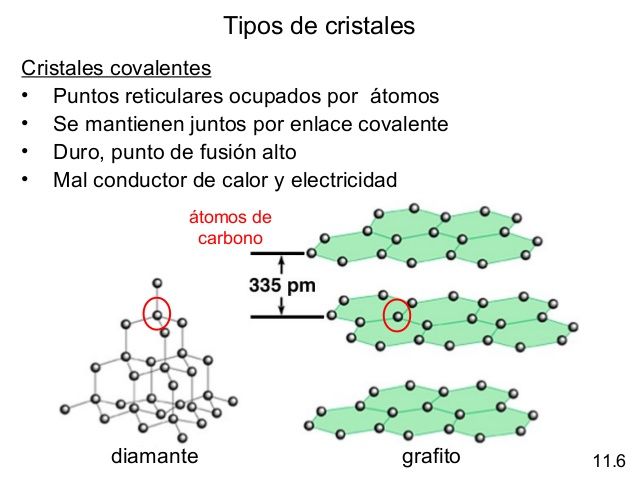
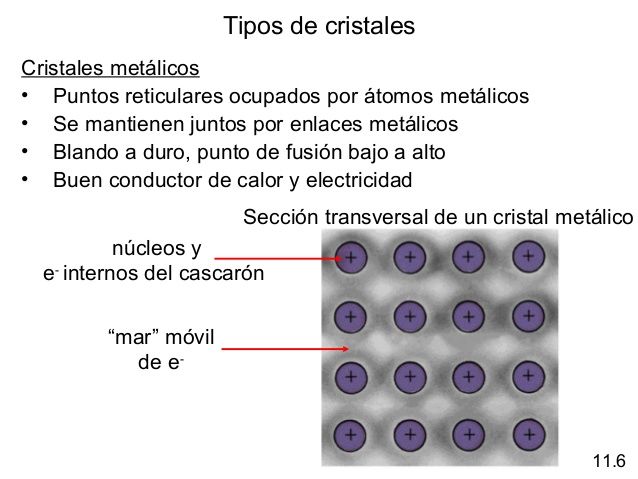
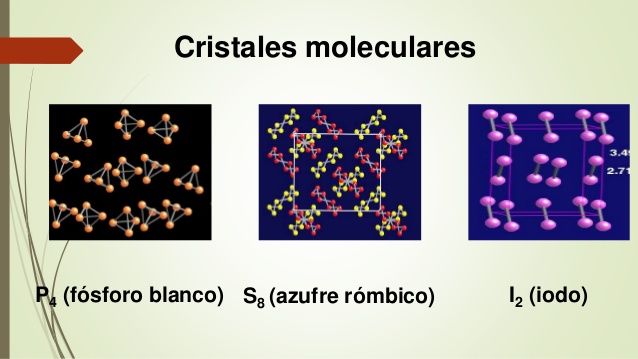
Celda unitaria: es la unidad estructural que se repite en un sólido cristalino, cuyos vértices (iones, átomos o moléculas) son llamados puntos reticulares.
El número de coordinación se define como el número de átomos (o iones) que rodean a un átomo (o ion) en una red cristalina. Las estructuras y propiedades de los cristales están determinadas por el tipo de fuerzas que mantinen unidas a las partículas.
Presión de vapor:
La evaporización es cuando las moléculas de un líquido tienen suficiente energía para escapar de la superficie y sucede un cambio de fase.
La condensación es cuando la concentración de las moléculas en fase vapor aumenta y algunas regresan a la fase líquida.
Calor molar de vaporización: la energía (KJ) necesaria para evaporar un mol de un líquido.
Punto de ebullición: la temperatura a la cual la presión de vapor de un líquido es igual a la presión externa.
Licuefacción o licuación de los gases: el cambio de estado que ocurre cuando una sustancia pasa del estado gaseoso al líquido, por el aumento de presión (compresión isoterma) y la disminución de la temperatura (expansión adiabática), llegando a una sobrepresión elevada, hecho que diferencia a la licuefacción.
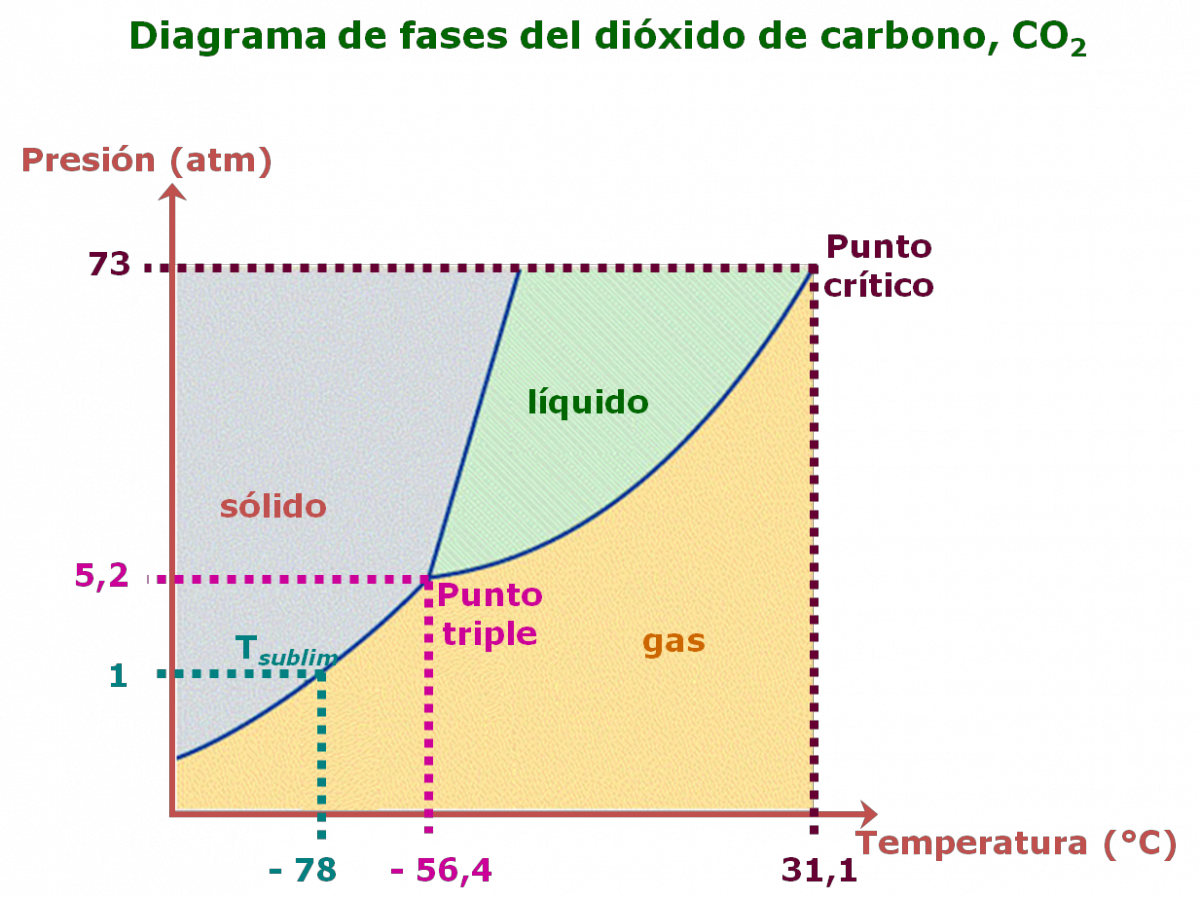
Sublimación: proceso en el cual las moléculas pasan directamente de sólido a vapor.
Deposición: transición directa de vapor a sólido.
Punto triple: la única condición de temperatura y presión a la cual las tres fases pueden estar en equilibrio simultáneamente.

 Hide known cards
Hide known cards